Validierung von design, herstellprozessen und computersystemen
produktions- und SterilisationsProzesse
Der Prototyp ist toll! Und Jetzt? inmedis unterstützt Sie beim Design Transfer Ihres Medizinproduktes. Unsere Experten begleiten Sie von der Validierungsplanung durch die Qualifizierungen (DQ / IQ / OQ / PQ) bis zur Freigabe Ihrer validierten Prozesse für die Serienproduktion. Dies schliesst auch die Qualifizierung und Überwachung von Reinräumen, sowie Verpackungs- und Sterilisationsprozessen von sterilen Medizinprodukten mit ein.
produktDesign und Packmittelintegrität
inmedis unterstützt Sie beim MDR-konformen Nachweis der Sicherheit und Leistung Ihres Medizinproduktes, inklusive dessen Verpackung. Wir begleiten Sie bei der Planung der Verifizierungs- und Validierungstätigkeiten, bei Alterungs- und Transportsimulationen und bei der abschliessenden Dokumentation der Ergebnisse. Damit nebst Ihren Kunden auch die Behörden von der Sicherheit und Effektivität Ihres Produktes überzeugt sind.
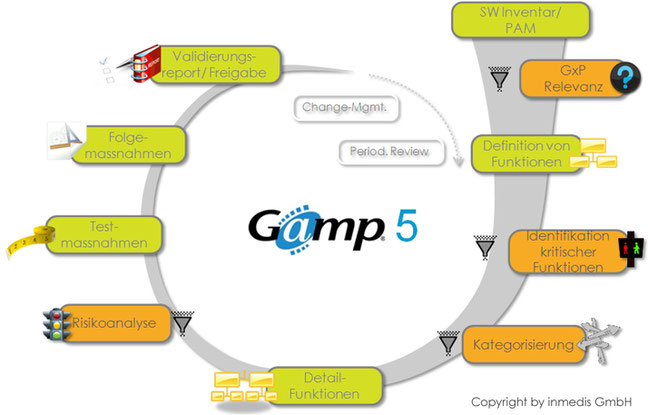
Computersysteme (CSV)
Vertrauen Sie Ihrer Business-Software? Softwarevalidierung muss kein Fass ohne Boden sein. Durch unseren risikobasierten Ansatz nach GAMP 5 können wir die Validierung auf die tatsächlich relevanten Software-Funktionen fokussieren. Wir beurteilen Ihre Business-Software hinsichtlich deren Einfluss auf die
- Qualität Ihrer Produkte
- Patientensicherheit
- Datenintegrität
und erfüllen somit auch die Anforderungen der ISO 13485:2016.
Sebastian Weibel, Director of Production Engineering, Medela AG
"Durch den sehr kompetenten Support konnten der Bereich der Prozessvalidierung massgeblich verbessert werden und hat so ein hohes Mass an Effektivität und Effizienz gewonnen. Mit der praktische Erfahrung und dem fundierten technischen Verständnis war der Support und das Coaching in der Umsetzung ebenso gewinnbringend. Dabei wurde nie vergessen die Menschen gekonnt zu involvieren, was zu einer grossen Akzeptanz geführt hat."

Gerne beraten wir Sie in einem kostenlosen Telefontermin
über die positiven Effekte übersichtlicher und gut strukturierter
Prozesse und erstellen Ihnen ein attraktives Angebot.

We would be happy to advise you in a free telephone call about the positive effects of clear and well-structured processes and prepare an attractive offer for you.




